Nội dung toàn tập
Phần 1: pH là gì?
Về lý thuyết pH, pH là đặc tính hóa học chỉ ra độ acid (độ chua) và độ bazơ (độ kiềm) của một dung dịch.
- Dung dịch chứa acid sẽ có vị chua hoặc đắng (vd. chanh, Coca-Cola…).
- Dung dịch chứa bazơ gây cảm giác ăn da (giống như nước xà phòng)

Theo lý thuyết pH, pH là hệ quả của quá trình tự phân ly acid và bazơ trong dung dịch (vd. dung môi nước):
| HCl | + | H2O | → | H3O+ | + | Cl– | Hydrochloric acid |
| H2SO4 | + | 2 H2O | → | 2 H3O+ | + | SO42- | Sulfuric acid |
| HNO3 | + | H2O | → | H3O+ | + | NO3– | Nitric acid |
| CH3COOH | + | H2O | → | H3O+ | + | CH3COO– | Acetic acid |
| NaOH | → | Na+ | + | OH– | Caustic soda | ||
| NH3 | + | H2O | → | NH4+ | + | OH– | Ammonia |
Hàm lượng ion H3O+ và OH– trong dung dịch xác định dung dịch là acid (nhiều H3O+ hơn OH–) hay bazơ (ít H3O+ hơn OH–)
Bản thân dung môi nước chứa đồng thời cả ion acid và bazơ
- Phân tử nước tự phân ly để tạo ra 1 acid H3O+ và 1 bazơ OH–
- Phương trình phân ly
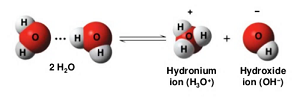
- Hằng số phân lý của nước là
Kw = [H3O+] [OH–] = 10-14 (tùy theo nhiệt độ)
- Có nghĩa là khoảng nồng độ H3O+ và OH– khác nhau ở những nhiệt độ khác nhau
| Nhiệt độ của nước | 0°C | 10°C | 18°C | 25°C | 30°C | 50°C | 60°C | 70°C | 80°C | 90°C | 100°C |
| Kw*10-14 | 0.1 | 0.3 | 0.7 | 1.2 | 1.8 | 8 | 12.6 | 21.2 | 35 | 53 | 73 |
Định nghĩa pH
Giá trị pH được định nghĩa là trừ của logarit của nồng độ ion hydrogen (cH+)
pH = – log cH+
Bất cứ số nào có dạng 10-x, thì logarit của nó là -x
Nghĩa là tương ứng với các nồng độ ion H+ :
| 0.1 mol/l | = | 10-1 mol/l | → | pH = 1 |
| 0.01 mol/l | = | 10-2 mol/l | → | pH = 2 |
| 0.001 mol/l | = | 10-3 mol/l | → | pH = 3 |
=> Lưu ý: Giá trị pH giảm đi 1, thì dung dịch chứa nhiều acid hơn gấp 10 lần!
Phần 2: Tại sao phải đo pH?
Giá trị pH là yếu tố quyết định trong dung dịch
- là đặc trưng cho từng sản phẩm
- ảnh hưởng sự phát triển của vi sinh vật
- ảnh hưởng tuổi thọ của dược phẩm
- ảnh hưởng hương vị của thực phẩm và đồ uống
- ảnh hưởng tốc độ phản ứng hóa học
- ảnh hưởng tính chất của các loại dầu
- ảnh hưởng cách sử dụng mỹ phẩm
- là bắt buộc phải được đo theo các quy định khác nhau
- …và nhiều lí do khác!

pH được ứng dụng rộng rãi trong nhiều ngành nghề
- Nước uống
- Ngành thực phẩm và đồ uống
- Dược phẩm
- Nước thải sinh hoạt và công nghiệp
- Ngành công nghiệp mỹ phẩm
- Quá trình hóa học
- Giáo dục và trường đại học
- Ứng dụng trong y tế
- Quy trình sinh học
- Nhiều hơn…

Phần 3: Nguyên lý đo lường pH
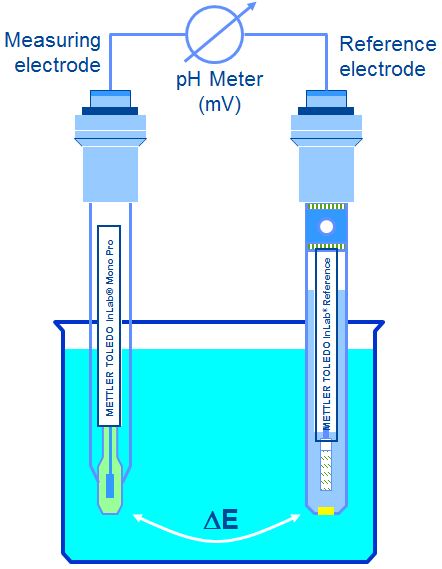
Giá trị pH được đo bằng phương pháp điện thế
- Hệ thống gồm có
– Máy đo điện thế (ở đây là pH meter)
– 1 điện cực đo (điện cực pH)
– 1 điện cực chuẩn (điện cực quy chiếu)
- Chênh lệch thế ∆E (mV) giữa 2 điện cực là:
∆E = EMeas – Eref
- Mạch điện: Hai điện cực tiếp xúc với nhau thông qua dung dịch mẫu (tạo thành mạch điện khép kín)
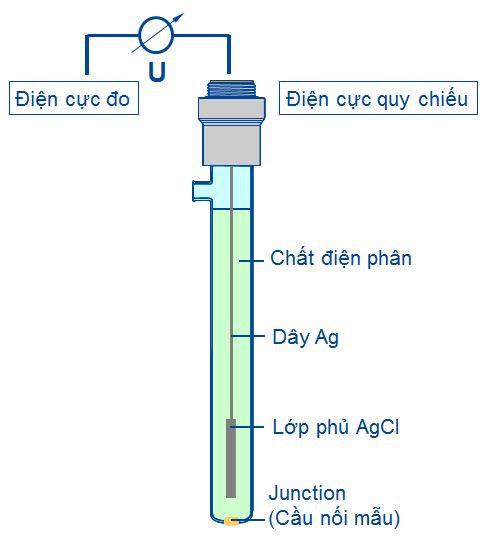
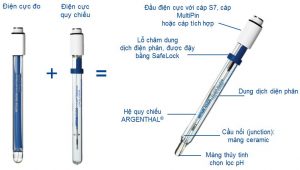
Điện cực quy chiếu
- Thế quy chiếu (ERef) phải là hằng số
- Sự thay đổi của ∆E chỉ phụ thuộc vào thế điện cực đo (EMeas)
- Hệ quy chiếu chuẩn có chứa: Ag/AgCl
- Chất điện phân của điện cực quy chiếu phải chảy qua cầu nối (junction) vào mẫu liên tục trong quá trình đo để tạo mạch kín với dòng chi chuyển của điện tích, ion và electron
⇒ Điện cực quy chiếu còn có tên khác là điện cực chuẩn, điện cực so sánh
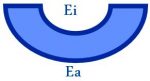
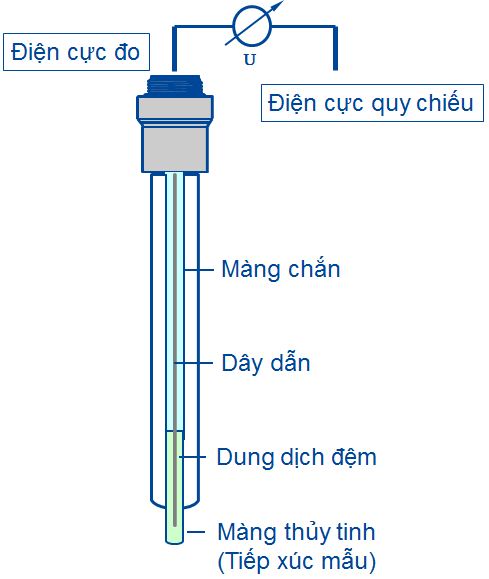
Điện cực đo
- EMeas là thế của màng thủy tinh chọn lọc pH
- EMeas là chênh lệch giữa thế màng thủy tinh bên trong và bên ngoài của màng điện cực pH
EMeas = Ea – Ei
- Một điện thế sẽ được tạo ra khi Ea ≠ Ei
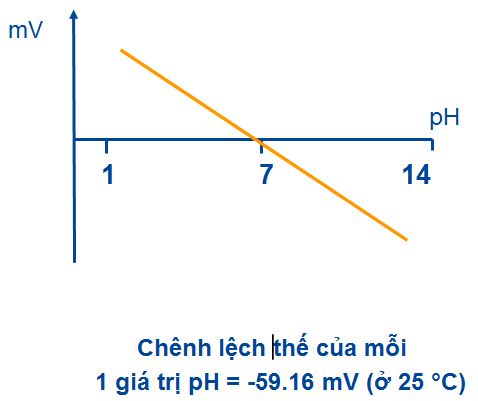
Phương trình Nernst
E = Eo + 2.3 RT/F • log cH+
E = Eo + 2.3 RT/F • pH
E Thế đo
Eo Thế chuẩn
R Hằng số khí lý tưởng
T Nhiệt độ (Kelvin)
F Hằng số Faraday
2.3 RT/F Nernst potential (slope)
cH+ Nồng độ H+ của dung dịch
Cảm biến pH tích hợp – 2 điện cực trong một điện cực
Mối quan hệ điện thế và giá trị pH – Phương trình Nernst

Phần 4: Hiệu chuẩn & Hiệu chỉnh máy đo pH
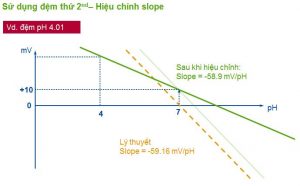
Là thao tác để bù lại sự sai khác giữa lý thuyết và thực tế
- Hiệu chuẩn (Calibration): là quá trình xác định khác biệt giữa giá trị đo và giá trị thực tế
- Hiệu chỉnh (Adjustment): là quá trình điều chỉnh giá trị đo trong thực tế và giá trị đúng của dung dịch
- Trong đo lường pH, thuật ngữ “hiệu chuẩn” điện cực là bao gồm cả “hiệu chuẩn và hiệu chỉnh”
- “Hiệu chuẩn” thực hiện với các dung dịch đã biết trước giá trị pH (vd. đệm pH chuẩn)
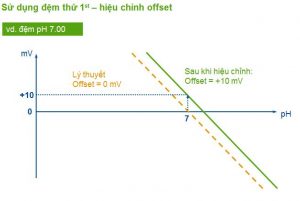
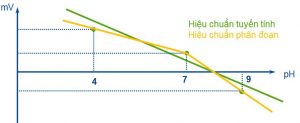
Hiệu chuẩn tuyến tính (Linear) và hiệu chuẩn phân đoạn (Segmented)
- Hiệu chuẩn tuyến tính sử dụng phép hối quy tuyến tính
→ Một đường chuẩn đi qua tất cả các điểm - Hiệu chuẩn phân đoạn sử dụng được cho từ 3 điểm trở lên
→ Nhiều đường chuẩn đi các điểm liên tục - Hiệu chuẩn phân đoạn giúp phép đo chính xác hơn, và được khuyến khích khi hiệu chuẩn với 3 điểm
Phần tóm lược nội dung
Bài viết đã sơ lược những nội dung cơ bản về:
- pH là gì?
- Tại sao phải đo pH?
- Máy đo pH và nguyên lý đo lường pH
- Hiệu chuẩn và hiệu chỉnh máy đo pH
Xem thêm những bài viết sau để hiểu thêm về máy đo pH:

